Substância – Conceito, Definições, Tipos E Exemplos – Conceitos Do Mundo: Mergulhe conosco no fascinante mundo da matéria! Exploraremos o conceito de substância, desde as definições clássicas de filósofos como Aristóteles e Descartes até a compreensão científica moderna. Veremos como a classificação de substâncias, considerando seus estados físicos (sólido, líquido, gasoso e plasma) e composição química (simples e compostas), é fundamental para entender o universo que nos cerca.
Preparado para desvendar os segredos da matéria e suas inúmeras aplicações no nosso dia a dia?
De substâncias presentes em nosso cotidiano, como a água e o oxigênio, a materiais complexos usados na indústria e na medicina, analisaremos suas propriedades e aplicações, explorando a relação entre estrutura molecular e comportamento. A jornada inclui tabelas comparativas, exemplos concretos e uma discussão sobre a importância da classificação das substâncias para a compreensão dos fenômenos naturais. Vamos explorar desde o microscópico ao macroscópico, desvendando os mistérios da matéria.
Conceito de Substância: Substância – Conceito, Definições, Tipos E Exemplos – Conceitos Do Mundo
A compreensão do conceito de substância perpassa séculos de filosofia e ciência, sofrendo transformações significativas ao longo da história. Inicialmente, a ideia de substância estava intrinsecamente ligada à noção de uma essência imutável, um substrato fundamental que permanecia constante mesmo diante de mudanças superficiais. Esta perspectiva influenciou profundamente o pensamento ocidental, moldando a maneira como entendemos a realidade e seus componentes.
Definição Clássica de Substância e suas Implicações
A definição clássica de substância, fortemente influenciada pela metafísica aristotélica, caracteriza-a como uma entidade independente, com existência própria e que possui propriedades intrínsecas. Para Aristóteles, a substância era a realidade primária, o sujeito de predicados, aquilo que realmenteé*. Essa visão implicava uma ontologia essencialista, onde a essência de uma coisa determinava suas propriedades e seu comportamento. A implicação crucial é a ideia de uma realidade objetiva, independente do observador, com entidades que possuem uma identidade inata e duradoura.
Esta concepção influenciou profundamente a ciência, embora tenha sido posteriormente desafiada por abordagens mais dinâmicas e relacionais.
Abordagens Filosóficas sobre o Conceito de Substância
Diferentes pensadores abordaram o conceito de substância de maneiras distintas. Aristóteles, como mencionado, via a substância como uma entidade independente com forma e matéria. Descartes, por sua vez, propôs uma distinção radical entre substância mental (res cogitans) e substância material (res extensa), afirmando que a mente e o corpo são entidades fundamentalmente diferentes, embora interagem. Já Leibniz, com sua teoria das mônadas, postulou que a realidade é composta por unidades indivisíveis e auto-suficientes, cada uma com sua própria percepção do universo.
Estas diferentes abordagens demonstram a complexidade e a multifacetada natureza do conceito de substância, refletindo as diferentes perspectivas filosóficas sobre a realidade. A discussão sobre a natureza da substância continua a ser um tema central na filosofia contemporânea, com abordagens processuais e relacionais desafiando as visões substancialistas tradicionais.
Propriedades de Diferentes Tipos de Substâncias

A classificação da matéria em diferentes estados físicos (sólidos, líquidos, gases e plasma) oferece uma perspectiva científica sobre a diversidade de substâncias. As propriedades destas substâncias variam significativamente devido à organização e interação de suas partículas constituintes.
| Tipo de Substância | Forma | Volume | Exemplo |
|---|---|---|---|
| Sólido | Forma definida | Volume definido | Gelo, ferro, madeira |
| Líquido | Forma indefinida (assume a forma do recipiente) | Volume definido | Água, álcool, mercúrio |
| Gás | Forma indefinida | Volume indefinido (expande para preencher o recipiente) | Oxigênio, nitrogênio, dióxido de carbono |
| Plasma | Forma indefinida | Volume indefinido | Raios, estrelas, lâmpadas fluorescentes |
Evolução Histórica da Compreensão do Conceito de Substância na Ciência

A compreensão científica da substância evoluiu dramaticamente ao longo da história. A alquimia, por exemplo, buscava transformar substâncias em outras, baseada em uma concepção de elementos fundamentais (terra, ar, fogo e água) que hoje sabemos ser uma simplificação excessiva. A revolução científica, com o trabalho de cientistas como Boyle e Lavoisier, introduziu o conceito de elemento químico, marcando uma transição para uma compreensão mais precisa da composição da matéria.
A descoberta dos átomos e posteriormente das partículas subatômicas (prótons, nêutrons e elétrons) revolucionou completamente a visão de substância, revelando a estrutura interna da matéria e a possibilidade de transformações nucleares. A física moderna, com a teoria da relatividade e a mecânica quântica, trouxe ainda mais complexidade à compreensão da substância, desafiando a própria noção de uma realidade objetiva e independente.
A evolução contínua da ciência continua a refinar e expandir nossa compreensão do conceito de substância, revelando sua intrincada e fascinante natureza.
Tipos de Substâncias
A classificação das substâncias é fundamental para a compreensão da química e dos fenômenos naturais. Organizar as substâncias em categorias permite prever seu comportamento e propriedades, facilitando o estudo e a manipulação da matéria. Esta classificação considera principalmente o estado físico e a composição química.
A matéria pode existir em diferentes estados físicos: sólido, líquido, gasoso e plasma. Cada estado apresenta características distintas em termos de forma, volume e organização das partículas. Além disso, as substâncias podem ser classificadas de acordo com sua composição química: substâncias simples, formadas por átomos de um único elemento químico, e substâncias compostas, formadas por átomos de dois ou mais elementos químicos diferentes.
Classificação das Substâncias por Estado Físico e Composição Química
A seguir, apresentamos uma lista categorizando os tipos de substâncias considerando seu estado físico e composição química. Essa organização permite uma visão mais completa da diversidade da matéria.
- Sólido:
- Substância Simples: Ferro (Fe), Carbono (C) (grafite e diamante são formas alotrópicas do carbono), enxofre (S).
- Substância Composta: Cloreto de Sódio (NaCl), Gelo (H₂O), Dióxido de Silício (SiO₂).
- Líquido:
- Substância Simples: Mercúrio (Hg), Bromo (Br₂).
- Substância Composta: Água (H₂O), Álcool (C₂H₅OH), Ácido Sulfúrico (H₂SO₄).
- Gasoso:
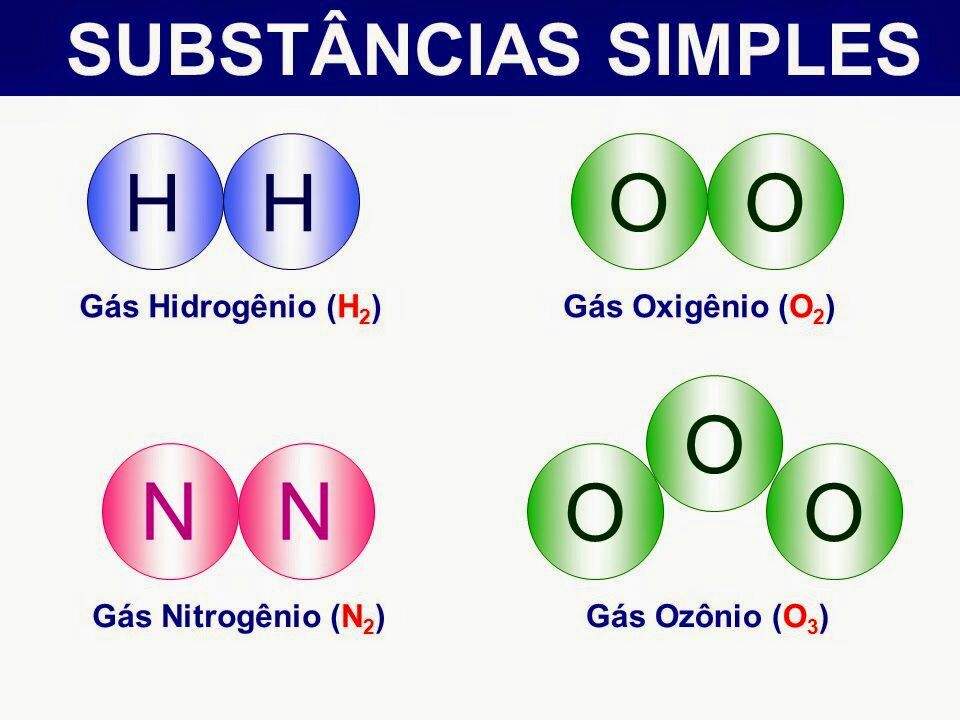
- Substância Simples: Oxigênio (O₂), Nitrogênio (N₂), Hidrogênio (H₂), Hélio (He).
- Substância Composta: Dióxido de Carbono (CO₂), Metano (CH₄), Amônia (NH₃).
- Plasma:
- Substância Simples e Composta: O plasma é um estado da matéria ionizada, podendo ser composto por átomos de um único elemento (simples) ou por uma mistura de elementos (composta). Exemplos incluem o Sol e as estrelas, que são compostos principalmente por plasma de hidrogênio e hélio.
Propriedades Físicas e Químicas das Substâncias
As propriedades físicas e químicas são características que permitem diferenciar e identificar as substâncias. As propriedades físicas podem ser observadas sem alterar a composição da substância, enquanto as propriedades químicas descrevem como a substância reage com outras substâncias.
Algumas propriedades físicas importantes incluem ponto de fusão (temperatura em que a substância muda do estado sólido para o líquido), ponto de ebulição (temperatura em que a substância muda do estado líquido para o gasoso), densidade (massa por unidade de volume) e solubilidade (capacidade de uma substância se dissolver em outra).
Propriedades químicas incluem reatividade (capacidade de reagir com outras substâncias), combustão (capacidade de queimar), e corrosão (degradação por reação química).
Tabela Comparativa de Propriedades
A tabela a seguir compara as propriedades físicas de três substâncias: água, ferro e oxigênio. Observe as diferenças significativas entre elas, demonstrando a diversidade de propriedades entre diferentes tipos de substâncias.
| Substância | Ponto de Fusão (°C) | Ponto de Ebulição (°C) | Densidade (g/cm³) | Solubilidade em Água |
|---|---|---|---|---|
| Água (H₂O) | 0 | 100 | 1 | Totalmente solúvel |
| Ferro (Fe) | 1538 | 2862 | 7,87 | Insolúvel |
| Oxigênio (O₂) | -218 | -183 | 0,0014 (a 0°C e 1 atm) | Pouco solúvel |
Importância da Classificação das Substâncias, Substância – Conceito, Definições, Tipos E Exemplos – Conceitos Do Mundo
A classificação das substâncias é crucial para a compreensão dos fenômenos naturais. Ela permite previsões sobre o comportamento da matéria em diferentes condições, auxiliando no desenvolvimento de tecnologias e na resolução de problemas ambientais. Por exemplo, o conhecimento das propriedades físicas e químicas da água é fundamental para a compreensão dos ciclos hidrológicos e para o desenvolvimento de sistemas de tratamento de água.
Da mesma forma, o conhecimento das propriedades do ferro é essencial para a engenharia e a construção civil.
Exemplos de Substâncias e suas Aplicações
No nosso dia a dia, interagimos com inúmeras substâncias, muitas vezes sem nos dar conta de suas propriedades e aplicações complexas. Compreender essas características é fundamental para valorizar a ciência dos materiais e a engenharia que nos rodeia. Este segmento explorará exemplos concretos de substâncias, suas propriedades e aplicações em diversos setores.
Substâncias no Cotidiano e suas Aplicações
A água (H₂O), por exemplo, é uma substância essencial à vida, apresentando propriedades únicas como a alta tensão superficial, o alto calor específico e a capacidade de atuar como solvente universal. Suas aplicações são inúmeras: desde o consumo humano e a agricultura até a indústria, onde é utilizada em processos de resfriamento, limpeza e como reagente químico. O aço, uma liga metálica composta principalmente de ferro e carbono, é um material resistente e versátil, amplamente empregado na construção civil, na indústria automobilística e na fabricação de eletrodomésticos.
Sua resistência e maleabilidade são resultado da interação entre os átomos de ferro e carbono em sua estrutura cristalina. O polietileno (PE), um polímero termoplástico, é um material leve, flexível e impermeável, usado na produção de embalagens, filmes plásticos e diversos utensílios domésticos. Sua estrutura molecular, composta por longas cadeias de carbono e hidrogênio, confere-lhe essas propriedades.
Comparação entre Substâncias com Funções Semelhantes: Aço e Alumínio

Aço e alumínio são ambos metais amplamente utilizados na construção e em outras indústrias, desempenhando funções estruturais semelhantes. O aço, devido à sua alta resistência e dureza, é ideal para estruturas que exigem grande resistência mecânica, como pontes e edifícios. Porém, sua alta densidade o torna mais pesado que o alumínio. O alumínio, por sua vez, apresenta menor densidade e alta resistência à corrosão, sendo preferido em aplicações onde o peso é um fator crítico, como na indústria aeronáutica e em componentes de veículos.
Sua menor resistência mecânica, comparada ao aço, limita seu uso em estruturas que demandam alta capacidade de carga. Portanto, a escolha entre aço e alumínio depende da aplicação específica, considerando a relação entre resistência, peso e custo.
Propriedades e Aplicações do Dióxido de Carbono e seus Impactos Ambientais

O dióxido de carbono (CO₂) é um gás incolor e inodoro, com fórmula molecular linear O=C=O. É um produto da respiração celular e da combustão de combustíveis fósseis. Na indústria, é utilizado na produção de bebidas carbonatadas, como refrigerante, e em extintores de incêndio, devido à sua capacidade de extinguir chamas ao deslocar o oxigênio. O CO₂ também é utilizado em processos industriais como a produção de ureia e de outros compostos químicos.
Entretanto, o aumento da concentração de CO₂ na atmosfera, resultante principalmente da queima de combustíveis fósseis, contribui para o efeito estufa e para as mudanças climáticas, representando um grave impacto ambiental. O aumento da temperatura global ocasiona o derretimento de geleiras, aumento do nível do mar e alterações nos padrões climáticos, com consequências devastadoras para os ecossistemas e para a sociedade.
Relação entre Estrutura Molecular e Propriedades: Água e Metanol
A água (H₂O) e o metanol (CH₃OH) são ambos compostos polares, devido à presença de ligações covalentes polares entre átomos com diferentes eletronegatividades. No entanto, a presença de um grupo metil (CH₃) no metanol confere a ele propriedades diferentes da água. A água, devido às suas ligações de hidrogênio intermoleculares, apresenta um ponto de ebulição muito mais alto que o metanol.
Essa forte interação intermolecular também é responsável pela sua alta tensão superficial e sua capacidade de atuar como solvente para muitas substâncias polares. O metanol, por sua vez, possui um ponto de ebulição menor e é mais volátil que a água, devido à menor intensidade das forças intermoleculares. Essa diferença nas propriedades é diretamente relacionada às suas diferentes estruturas moleculares e às forças intermoleculares presentes.
Ao concluir nossa exploração do conceito de substância, fica evidente a riqueza e a complexidade da matéria que nos rodeia. Desde as definições filosóficas até as aplicações científicas e tecnológicas, compreendemos a importância da classificação e da análise das propriedades das substâncias para a compreensão do mundo. A diversidade de substâncias, suas interações e suas aplicações moldam nosso universo, desde os processos naturais até as inovações tecnológicas.
Esperamos que esta jornada tenha expandido sua compreensão sobre este tema fundamental.

