Descubra o fascinante mundo das Reações Reversíveis Exemplos Do Dia A Dia, onde as transformações químicas ocorrem em ambos os sentidos, criando um equilíbrio dinâmico que molda nosso mundo.
Essas reações reversíveis estão presentes em diversos processos cotidianos, desde a dissolução do dióxido de carbono na água até a oxidação do ferro. Vamos mergulhar nessa jornada química para entender seu funcionamento e sua importância para a vida como a conhecemos.
Definição de Reações Reversíveis
Reações reversíveis são reações químicas que podem ocorrer em ambas as direções, ou seja, os reagentes podem se transformar em produtos e os produtos podem se transformar novamente em reagentes. Essas reações são representadas por uma seta dupla (⇌) na equação química.
Um exemplo de reação reversível é a reação de dissociação do ácido acético:
CH 3COOH ⇌ CH 3COO –+ H +
Nesta reação, o ácido acético (CH 3COOH) pode se dissociar em íons acetato (CH 3COO –) e íons hidrogênio (H +). No entanto, os íons acetato e íons hidrogênio também podem se recombinar para formar ácido acético.
Fatores que Afetam as Reações Reversíveis: Reações Reversíveis Exemplos Do Dia A Dia

As reações reversíveis são influenciadas por diversos fatores que podem deslocar o equilíbrio da reação. Esses fatores incluem concentração, temperatura e pressão, e seu entendimento é essencial para prever e controlar reações químicas.
O princípio de Le Chatelier estabelece que, quando um sistema em equilíbrio é perturbado, ele se ajustará para minimizar a perturbação. Isso significa que, se um fator que afeta o equilíbrio for alterado, a reação se deslocará para compensar essa mudança e restabelecer o equilíbrio.
Concentração, Reações Reversíveis Exemplos Do Dia A Dia
Aumentar a concentração dos reagentes deslocará o equilíbrio para o lado dos produtos, enquanto aumentar a concentração dos produtos deslocará o equilíbrio para o lado dos reagentes.
Temperatura
Para reações exotérmicas (que liberam calor), aumentar a temperatura deslocará o equilíbrio para o lado dos reagentes, enquanto diminuir a temperatura deslocará o equilíbrio para o lado dos produtos.
Pressão
Para reações que envolvem gases, aumentar a pressão deslocará o equilíbrio para o lado com menor número de moles de gás, enquanto diminuir a pressão deslocará o equilíbrio para o lado com maior número de moles de gás.
Exemplos de Reações Reversíveis no Cotidiano
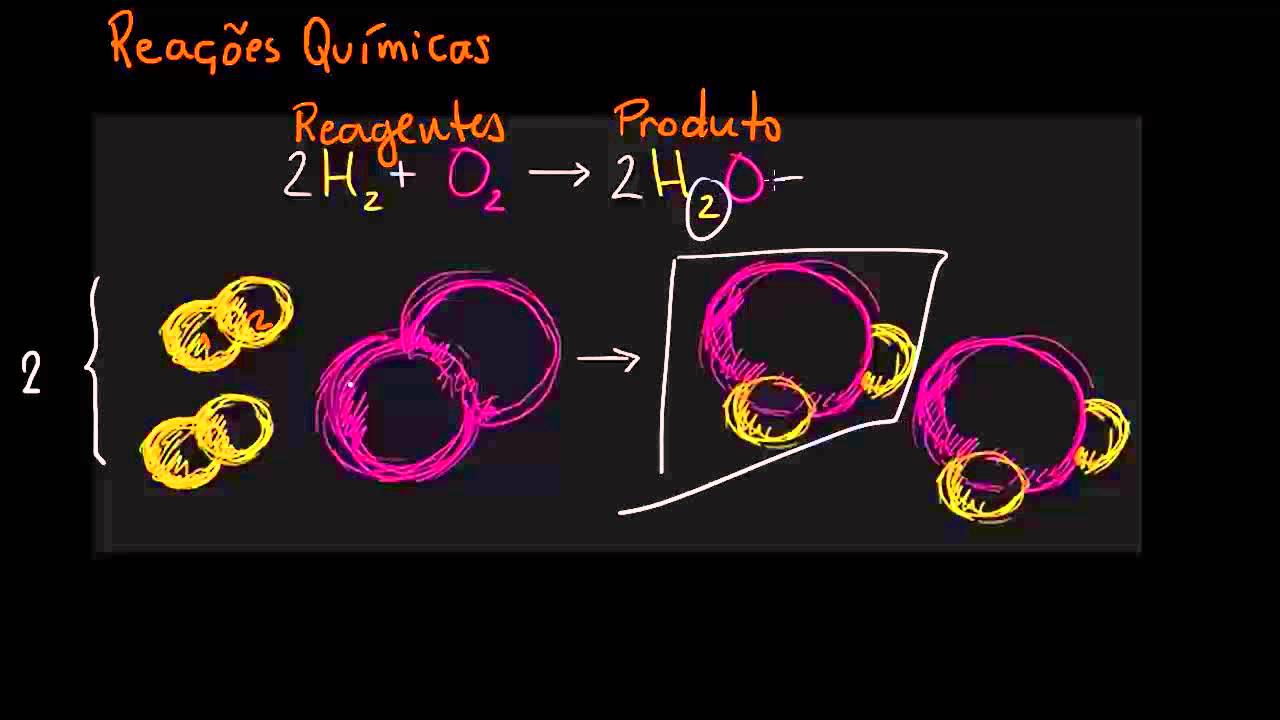
As reações reversíveis são comuns em nossa vida cotidiana. Aqui estão alguns exemplos:
A dissolução do dióxido de carbono na água:
CO 2(g) + H 2O (l) <=> H2CO 3(aq)
O equilíbrio desta reação é afetado pela temperatura e pressão. A baixa temperatura e alta pressão favorecem a dissolução do CO 2na água.
A oxidação do ferro:
Fe (s) + 3O2(g) <=> 2Fe2O 3(s)
O equilíbrio desta reação é afetado pela temperatura e concentração de oxigênio. A alta temperatura e alta concentração de oxigênio favorecem a formação de óxido de ferro.
Outros exemplos incluem:
- A dissolução de sal em água
- A reação do ácido acético com o bicarbonato de sódio
- A fermentação do açúcar
Aqui está uma tabela resumindo esses exemplos:
| Reação Química | Equilíbrio | Fatores que Afetam o Equilíbrio |
|---|---|---|
| CO2 (g) + H2O (l) <=> H2CO3 (aq) | Temperatura, pressão | Temperatura, pressão |
| 4Fe (s) + 3O2 (g) <=> 2Fe2O3 (s) | Temperatura, concentração de O2 | Temperatura, concentração de O2 |
Aplicações das Reações Reversíveis

As reações reversíveis desempenham um papel crucial em diversas aplicações práticas, incluindo a produção industrial e o controle ambiental.
Produção de Amônia
A produção de amônia é um exemplo fundamental de uma reação reversível. O processo Haber-Bosch, amplamente utilizado, envolve a reação entre nitrogênio e hidrogênio para formar amônia:
N2+ 3H 2⇌ 2NH 3
A reação é reversível, o que significa que a amônia pode se decompor em nitrogênio e hidrogênio. A otimização das condições de reação, como temperatura e pressão, é essencial para maximizar o rendimento de amônia.
Controle de Poluição
As reações reversíveis também são empregadas no controle da poluição. Por exemplo, a remoção de óxidos de nitrogênio (NOx) das emissões dos veículos pode ser alcançada por meio da reação reversível:
2NO2⇌ N 2O 4
O N 2O 4formado pode ser absorvido por uma solução aquosa, removendo efetivamente os NOx da atmosfera.
Importância das Reações Reversíveis

As reações reversíveis são cruciais para os sistemas biológicos e químicos, pois permitem que os processos atinjam o equilíbrio e a homeostase.
Em sistemas vivos, as reações reversíveis são essenciais para manter o equilíbrio dinâmico e a regulação do metabolismo. Por exemplo, a reação da respiração celular, que converte glicose em energia, é reversível, permitindo que o corpo adapte-se às flutuações nas demandas energéticas.
Equilíbrio e Homeostase
As reações reversíveis contribuem para o equilíbrio em sistemas químicos ao permitir que as reações prossigam em ambas as direções. Isso estabelece um estado dinâmico onde as concentrações dos reagentes e produtos permanecem constantes ao longo do tempo. Em sistemas biológicos, a homeostase é mantida por reações reversíveis que regulam a temperatura corporal, o pH e os níveis de nutrientes.
As Reações Reversíveis Exemplos Do Dia A Dia nos mostram a natureza dinâmica da química, onde as transformações são constantes e o equilíbrio é essencial. Elas são fundamentais para processos biológicos, controle de poluição e produção industrial, destacando sua relevância em diversos aspectos de nossas vidas.
Compreender essas reações é essencial para apreciar a complexidade e a beleza da química, tanto no laboratório quanto no mundo ao nosso redor.

